1-1
Dunia
Kimia Kita [Kembali]
1.1.1 Kimia dan Cara Hidup Kita
Dalam 45 tahun terakhir, penduduk
dunia telah menjadi dua kali lipat dan diduga akan melipat dua lagi dalam waktu
25 tahun mendatang. Hal ini disebabkan oleh penerapan pengetahuan kimia dalam
kedokteran dan pertanian.
Pada bidang kedokteran, kimia
mempengaruhi obat-obatan yang meningkatkan kesehatan dan antibiotika untuk
mengendalikan penyakit dan infeksi. Pada bidang pertanian, pupuk dan
insektisidan yang meningkatkan produksi makanan untuk memberi makan populasi.
Namun, dengan bertambah banyaknya penghuni
planet ini, maka penggunaan sumberdaya juga akan meningkat. Sehingga peracunan
persediaan air oleh residu residu insektisidan dan pemusnah rerumputan,
pencemaran udara oleh reaksi kimia yang berlangsung selama pembakaran bahan
bakar, terbunuhnya hewan dan tumbuhan oleh limbah proses industri. Hal ini merupakan permasalahan modern dengan nada
ikatan kimia.
Kesetimbangan yang paling menghawatirkan
adalah yang berlangsung dalam zone didekat permukaan bumi, yang disebut biosfer
1.1.2 Kimia Sebagai suatu Ilmu
Dalam kimia, seperti pada ilmu-ilmu
yang lain, perhatian dipusatkan pada fakta yang reprodusibel ( dapat
diulang ), yakni pada peristiwa atau kejadianyang berlangsung dengan cara yang
sama pada kondisi yang sama. Misal,
pembakaran 1 kg arang menghasilkan kalor dengan jumlah tertentu, air membeku
pada 0⁰ C,
dan karbohidrat diubah menjadi CO2 dan air dalam jaringan hewan.
Hipotesis serupa dengan suatu teori,
tetapi kurang resmi (formal) dan didasarkan pada studi yang kurang tuntas. Pembagian ilmu pengetahuan menjadi
fiiska, astronomi, geologi, botani, zoologi, kimia, dan ilmu-ilmu lain bukanlah
penggolongan oleh alam, melainkan oleh manusia. Ilmu kimia menyumbangkan banyak
gagasan ke berbagai cabang ilmu lain,
dan sangat penting bagi siapapun yang tertarik pada ilmu kedokteran,
meteorologi, teknologi pangan, pertanian maupun teknik (engineering).
- Pengukuran Ilmiah
Sudah satu abad ini, sistem metrik
dengan struktur desimalnya merupakan dasar pengukuran ilmiah, dan dalam
kebanyakan negeri juga merupakan penggunaan sehari-hari. Sistem metrik
dirancang dengan sengaja untuk menyajikan definisi yang jelas dan perhitungan
yang mudah, sedangkan Inggris hanyalah sekedar koleksi pengukuran dan satuan
yang tumbuh dalam sekian banyak tahun.
1-2 Satuan
SI Untuk Pengukuran [Kembali]
Satuan SI merupakan perluasan
logis (dari) sistem metrik, menghubungkan semua satuan pengukuran ke satuan
dasar yang sesedikit mungkin.
1.2.1 Tujuh Satuan
Dasar SI
Pengukuran semua besaran
(kuantitas) dapat dinyatakan dalam ke tujuh
satuan ini atau dari satuan yang diturunkan dari ke tujuh satuan ini.
Tabel
satuan dasar SI
Di Amerika Serikat orang banyak
menggunakan satuan SI dalam kehidupan sehari hari, karena manfaat sistem ini
membantu dalam pendidikan, ilmu pengetahuan, efisiensi industri, dan
perdagangan internasional.
Untuk menyatakan pecahan atau
kelipatan desimal satuan SI, digunakan suatu sistem awalan . Awalan pecahan
diturunkan dari akar Latin dan awalan kelipatan diturunkan dari akar Yunani.
Awalan yang paling lazim adalah
1.2.2 Satuan Panjang, Luas dan Volume
Satuan
SI untuk panjang adalah meter (m), yaitu 39,37 inch atau sekitar 1,1 yard. 1
kilometer
sama dengan 0,62 mil. 1 cm sama
dengan 0,39 inch.
Satuan
luas dan volume diturunkan dari satuan panjang.
Satuan SI luas dan volume adalah meter persegi dan meter kubik (m2 dan m2). Namun, dalam laboratorium satuan yang biasa dipakai
adalah cm2 dan m2
untuk luas dan cm3 dan mm3 untuk volume.
1.2.3 Satuan Massa dan
Rapatan
Satuan SI untuk massa adalah Kilogram,
setara dengan 2,2 pon3.
Seperseribu bagian sari kilogram adalah gram. Dalam laboratorium yang dipakai
adalah miligram dan gram.
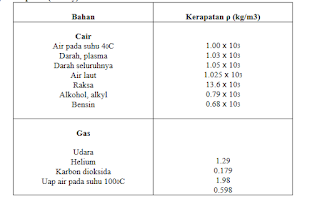
Rapatan suatu zat merupakan massa per satuan
volume. Satuan yang lazim digunakan di labratorium adalah gram per sentimeter
kubik g/cm3. rapatan sangat beraneka ragam. Rapatan zat padat
berbeda dengan faktor lebih dari 100. Diantara gas selisih itu juga sangat
besar, tetapi sebagai suatu kelompok, gas gas pada kondisi biasa dapat dianggap
mempunyai rapatan sekitar seperseribu rapatan cairan dan gas. Rapatan gas
sering dinyatakan dalam gram per liter. Gas Hidrogen merupakan yang
kerapatannya paling kecil, sedangkan zat padat osmium dan iridium merupakan
kerapatannya yang paling tinggi.
Tabel
kerapatan
Susu sebanyak 1 liter massanya
ternyata 1,032 kg. Lemak di dalam susu murni diketahui rapat massanya adalah
865 kg/m3. Diketahui pula kadar lemak adalah 4 % dari seluruh volume
susu. Berapakah rapat massa susu yang tidak mengandung lemak ?
Volume lemak dalam susu 1000 cm3 = 4% x 1000 cm3 = 40 cm3
Massa 40 cm3 lemak= Vῤ = ( 40 x 10-6 m3 ). ( 865 kg/m3 ) = 0,0346 kg
Rapat massa susu tanpa lemak = massa /volume = ( 1,032 – 0,0346 ) kg / ( 100 – 40 ) x 10-6 = 1039 kg/m3
Volume lemak dalam susu 1000 cm3 = 4% x 1000 cm3 = 40 cm3
Massa 40 cm3 lemak= Vῤ = ( 40 x 10-6 m3 ). ( 865 kg/m3 ) = 0,0346 kg
Rapat massa susu tanpa lemak = massa /volume = ( 1,032 – 0,0346 ) kg / ( 100 – 40 ) x 10-6 = 1039 kg/m3
Bobot
jenis (specific gravity)
adalah angka banding massanya dan massa air pada volume yang sama dan temperatur
tertentu. Untuk menentukan bobot jenis menggunakan wadah dengan volume yang
cermat, labu volumetri (
volumetric flask).
misalnya suatu labu volumetri 5,00-cm3 mengandung 4,99 g air pada 25⁰ C. Bila bobot diisi dengan bensin 3,58
g,
maka bobot jenis bensin adalah...
1.2.4
satuan temperatur dan energi
Didasarkan pada titik beku dan titik didih
air, selisihnya dibagi menjadi 100 bagian, sehingga disebut skala sentigrad
(centigrade). Pada tahun 1948, skala sentigrad disebut skala celsius (Anders
Celsius: 1742)
Temperatur
adalah sifat yang
menentukan arah aliran sertamerta (spontan) dari kalor (beat). Benda yang
temperaturnya lemah akan menerima energi panas dari benda bertemperstur tinggi
jika didekatkan.
Gambar
hubungan skala temperatur :
Energi
panas adalah energi yang
mengalir dari suatu benda panas ke benda yang lebih dingin. Satuannya adalah
kalori (kal). Satuan energi adalah Joule (J).
J = kg.m2. s-2
Kalor
jenis (Specific Heat)
adalah energi panas yang diperlukan nuntuk mengubah temperatur 1 g zat sebanyak
1⁰
C atau 1 ⁰K.
Tabel Kalor Jenis
Contoh
soal:
Suatu benda bermassa 2 kg menyerap kalor sebanyak 100 kalori
ketika suhunya berubah dari 20oC hingga 70oC. Kalor jenis
benda tersebut adalah…..
Pembahasan
Diketahui :
Massa (m) = 2 kg = 2000 gr
Kalor (Q) = 100 kal
Perubahan suhu (ΔT) = 70oC – 20oC = 50oC
Ditanya : Kalor jenis benda (c)
Jawab :
c = Q / m ΔT
c = 100 kal / (2000 gr)(50oC)
c = 100 kal / 100.000 gr oC
c = 102 kal / 105 gr oC
c = (102 kal)(10-5 gr-1 oC-1)
c = 10-3 kal gr-1 oC-1
c = 10-3 kal/gr oC
Kalor jenis benda tersebut adalah 10-3 kal/gr oC
1-3 Sifat Material [Kembali]
Tiap zat memiliki
seperangkat sifat atau ciri yang memperbedakannya dan memberi identitas yang
unik dengan memaparkan bebarapa sifat instrinstik mereka masing masing.
Sifat instrinstrik adalah
kualitas yang bersifat khas tiap contoh zat, tak peduli bentuk dan ukuran
contoh zat. Sifat ekstrinsik adalah sifat yang tidak khas dari zat itu
sendiri. Ukuran, bentuk, Panjang, bobot, dan temperatur adalah sifat
ektrenstrik.
1.3.1 sifat kimia
sifat kimia adalah
kualitas yang khas dari suatu zat yang menyebabkan zat tersebut dapat berubah,
baik sendirian maupun dengan berantaraksi dengan zat lain, dan dengan berubah
itu membentuk bahan-bahan berlainan. Sifat kimia termasuk ke dalam sifat
instrinsik. Contoh, bensin sangat mudah terbakar, sedangkan minyak tanah lebih
sulit terbakar. Besi mudah berkarat sedangkan emas tidak. Perbedaan sifat
tersebut karena perbedaan sifat kimianya.
1.3.2 sifat fisika
sifat fusika adalah sifat atau
karakteristik suatu zat yang membedakan dari zat-zat lain dan tidak melibatkan
perubahan apapun ke zat lain. Contohnya, titik didih, titik leleh, rapatan,
viskositas, kalor jenis, kekerasan. Kualitas dalam kelompok ini dapat diukur
dengan mudah dan dapat dinyatakan dengan bilangan. Zat yang dinamai alkohol
memiliki sifat fisika yang berbeda dibandingkan dengan aseton. Apabila diukur
sifat fisikanya, kedua zat ini akan memberikan hasil pengukuran yang berbeda.
1-4 Perubahan dalam Materi dan Energi [Kembali]
1.4.1 Perubahan dalam materi ini dapat dikelompokkan
dua judul :
Perubahan Kimia
Perubahan kimia mengakibatkan hilangnya zat-zat dan
terbentuknya zat-zat baru. Misalnya, bila suatu logam magnesium terbakar dalam
alat lampu bola potret, magnesium dalam bola lampu itu musnah. Sebagai sebagai
gantinya diperoleh suatu padatan bubuk yang tak dapat terbakar, magnesium
oksida, yang mempunyai seperangkat sifat yang unik.
Perubahan Fisika
Perubahan fisika adalah perubahan yang tidak
mengakibatkan pembentukan zat baru . misalnya, es meleleh menjadi air atau bila
pasir tergerus menjadi bubuk yang halus, tidah membentuk zat baru
1.4.2
Perubahan Energi
Energi suatu benda atau sistem adalah kemampuan
benda atau system ini melakukan kerja.
- Energi Listrik adalah macam energi yang dikaitkan dengan lewatnya suatu arus listrik.
- Energi Radiasi adalah macam energi yang dikaitkan dengan cahaya biasa. juga disebut radiasi elektro-magnetik. Semua radiasi semacam ini merambat dalam ruang kecepatan cahaya sebesar 3,00 X 108merer per detik (atau 186.000 mil per detik)
- Energi Kimia adalah energi yang dimiliki suatu zat karena ada zat kimianya. Misalnya bila batu bara dan bensin terbakar , atau bila makanan kita makan terbakar dalam sel sel kita, suatu energi kimia diubah menjadi energi panas .
- Energi Nuklir atau Energi Atom dikaitkan dengan cara cara atom itu disusun.
Sebenarnya semua bentuk energi dapat dikelompokkan
dalam dua kelas umum :
- Energi Kinetik ialah energi suatu benda karna gerakannya . Contohnya pada saat air mengalir lewat turbin, per arloji perlahan-lahan mengendor atau bensin terbakar, dalam mesin mobil, energi potensial diubah menjadi energi kinetik. Suatu mobil yang bergerak, bola yang sedang melambung, pesawat yang sedang terbang, semuanya memiliki energi kinetik.
Untuk
ilustrasi: tiga mobil identik bergerak satu dengan laju 20, satu dengan 40
dan yang
ketiga dengan 60 mil per jam. Maka energi kinetik berbanding sebagai 12
:22 : 32 = 1 : 4 : 9 Diperlukan kerja yang 9 kali lebih
besar untuk menghentikan mobil ketiga bandingkan
dengan mobil pertama. sedang bila massanya dilipatkan tiga sementara
kecepatannya tetap, energi kinetik itu hanya meningkat tiga kali.
Artinya,energi kinetik berbanding lurus dengan massa. Ketergantungan energi
kinetik pada massa dan kecepata dinyatakan oleh
- Energi Potensial , Energi yang dimiliki suatu benda karena posisinya atau karena benda itu berada dalam suatu keadaan yang bukan keadaan normal dari energi terendah. Air yang disimpan dalam reservoir di belakang bendungan berada dalam suatu posisi . untuk melakukan kerja dengan cara memutar suatu turbin atau kincir air dan karena itu memiliki energi potensial. Suatu per arloji yang diputar erat-erat juga memiliki energi potensial
- Perubahan Eksoterm dan Endoterm Jika zat-zat atau suatu zat tunggal berubah sedemkian rupa sehingga energi dilepaskan ke sekitarnya, perubahan itu dikatakan eksoterm (exothermic, kalor ke luar ). Eksoterm merujuk pada perubahan energi jenis apa saja, dilepaskan. Misalnya, bila magnesium terbakar dalam oksigen dan menghasilkan magnesium oksida, energi kimia diubah menjadi energi panas dan energi radiasi yang dipancarkan ke sekitarnya. Proses merupakan perubahan eksoterm. Bila karbondioksida dan air diubah menjadi glukosa dalam suatu tumbuhan hidup, energi radiasi dari matahari diubah menjadi energi kimia. Perubahan semacam itu, dalam mana bahan-bahan mengambil energi dari sekitarnya disebut endoterm. Pembentukan glukosa ini merupakan reaksi endoterm Reaksi magnesium dan oksigen untuk membentuk magnesium oksida adalah eksoterm, sedangkan penguraian magnesium oksida menjadi magnesium dan oksigen adalah perubahan endoterm. Banyaknya energi yang diperlukah untuk menguraikan sejumlah tertentu oksida sama besar dengan energi yang dilepaskan bila magnesium oksida sebanyak itu terbentuk. Contoh ini menggambarkan suatu asas mendasar : Suatu proses yang bersifat eksoterm dalam satu arah selalu bersifat endoterm dalam arah yang berlawanan.
1.4.3
Kelas kelas materi
Zat-.zat murni digolongkan sebagai unsur atau
senyawa. Unsur dapat digambarkan sebagi zat-zat yang tidak dapat diuraikan oleh
perubahan kimia sederhana menjadi dua zat berlainan atau lebih. Beberapa unsur
yang telah.dikenal oleh ahli kimia kuno adalah tembaga, perak, emas, belerang
(sulfur), karbon dan fosforus. Senyawa adalah zat dengan komposisi tertentu
yang dapat diuraikan oleh proses kimia sederhana menjadi dua zat berlainan atau
lebih Garam dapur, natrium klorida merupakan contoh senyawa. Zat kristalin
putih ini dapat diuraikan menjadi logam aktif mengkilap (natrium) dan suatu gas
kuning kehijauan dan bersifat racun (klor). Sifat-sifat zat yang diperoleh
dengan penguraian suatu senyawa sama sekali tak berhubungan dengan sifat-sifat
senyawa itu. Dewasa ini dikenal lebih dari 100 unsur, tetapi
lebih dari 4 juta senyawa. Beberapa senyawa yang lazim ialah air, gula,
alkohol, karbon dioksida dan amoniak.
- Campuran adalah bahan yang mengandung dua zat berlainan atau lebih yang
bercampur
dengan baik. Suatu campuran tak mempunyai perangkat sifat yang unik ;
sifatnya adalah sifat dari zat-zat penyusunnya. Udara merupakan campuran
gas; udara tersusun terutama dari nitrogen, oksigen, argon, uap air dan karbon
dioksida, dan masing-masing penyusun ini memperagakan sifat-sifatnya yang unik
dalam campuran itu. Komponen-komponen dalam campuran itu dapat dipisahkan
dengan proses fisika, bukan kimia. Misalnya, bila temperatur udara diturunkan,
uap air cenderung memisahkan diri dalam bentuk cairan atau zat padat, yakni
embun atau es (frost). Bila didinginkan lagi, karbon dioksida akan membeku dan
selanjutnya komponen-komponen udara lainnya akan mencair. Jika udara cair
dididihkan dengan hati-hati, campuran ini dapat dipisahkan, karena tiap
komponen cenderung mendidih dalam jangka temperature tertentu yang bergantung
pada titik didihnya.
- Distilasi Metoda memisah-misahkan zat dalam suatu campuran cairan dengan cara mendidihkan .
- Campuran homogen merujuk ke bahan dalam mana tak ada bagian-bagian yang dapat dibedakan satu dari yang lain, bahkan dengan mikroskop sekalipun, misalnya larutan gula dalam air.
- Campuran heterogen merujuk ke bahan dalam mana terdapat bagian-bagian yang nampak berlainan, misalnya campuran bubuk garam dan merica.
Gambar 1.9 alat untuk menyuling campuran tipe
tertentu








Tidak ada komentar:
Posting Komentar